Autorom článku je Vladimír Girman
Tuhé látky sa skladajú z atómov alebo iónov umiestnených tesne vedľa seba. Táto ich blízkosť je zdrojom rôznych charakteristických vlastností tuhých látok. Vzájomná súdržnosťdvoch atómov sa nazýva väzba a na základe jej povahy ju ktegorizujeme na niekoľko rôznych typov.
1.Kohézne sily v kryštáloch
Za súdržnosť kovových látok sú zodpovedné kohézne sily. Dominantnú úlohu tu zohráva príťažlivá elektrostatická interakcia medzi záporne nabitými elektrónmi a kladne nabitými jadrami atómov, ktorá sa riadi zákonmi kvantovej mechaniky. V úvahu pripadajú aj magnetické interakcie, tie sú však v porovnaní s elektrostatickou interakciou veľmi slabé.Ešte zanedbateľnejšie sú gravitačné sily. Všetky tieto interakcie zahŕňame tiež pod všeobecný pojem chemické väzby. Kohézne sily, ktoré sú samotnou podstatou chemických väzieb, sú vyjadrované cez kohéznu energiu. Táto kohézna energia vyjadruje energiu potrebnú na rozdelenie tuhej látky na jednotlivé atómy. Alebo ináč povedané,vyjadruje energiu potrebnú na oddelenie dvoch atómov, ktoré sú vo väzbe. Miera kohéznej energie je samozrejme závislá na niekoľkých faktoroch: druh častíc, charakter väzobných síl medzi časticami, ale aj teplotné, či iné fyzikálne pole. Význam kohéznej energie spočíva predovšetkým v tom, že určuje termodynamickú stabilitu konkrétneho kryštálu. Od toho sa potom odvíjajú takmer všetky vlastnosti kryštálov, vrátane mechanických. Na určenie kohéznej energie porovnávame celkovú energiu kryštálu, tzn. kinetickú a potenciálnu energiu,s energiou rovnakého počtu voľných atómov, nekonečne od seba vzdialených.Kryštál sa môže vytvoriť a byť stabilný iba vtedy, ak je jeho celková energia nižšia nežcelková energia jeho atómov vo voľnom stave. V tabuľke 1 sú uvedené kohézne energie niektorých čistých kovov pri tlaku 101 325 Pa a teplote o K. Ak by sme mali pred sebou periodickú tabuľku prvkov s vyznačením kohéznej energie pre každý prvok,zistili by sme,že pre jednotlivé triedy sú typické približne rovnaké hladiny kohéznej energie.
Tab.1: Kohézne energie niektorých prvkov
Fe | 4,28 |
Co | 4,39 |
Ni | 4,44 |
Cu | 3,49 |
Zn | 1,35 |
Zr | 6,25 |
Nb | 7,57 |
Mo | 6,82 |
Ag | 2,95 |
Pt | 5,84 |
Au | 3,81 |
Jedným z mnohých veľkých prínosov kvantovej mechaniky bolo to, že umožnila pochopiťpodstatu a povahu všetkých chemických väzieb. V tomto príspevku sa obmedzíme iba na väzby uplatňujúce sa v kovových kryštáloch, kde rozoznávame štyri mechanizmy, ktorými súmedzi sebou viazané atómy. Jedná sa o kovovú, iónovú, kovalentnú a van der Waalsovúväzbu. Všetky tieto väzby sú elektrónového pôvodu, takže obecne môžeme povedať,že hlavný a podstatný rozdiel medzi nimi spočíva v prerozdelení valenčných elektrónov okolo atómov.
2.1 Iónová väzba
Tento typ väzby vzniká medzi atómami, ktoré nemajú zaplnené valenčné elektrónové vrstvy.Dobrým príkladom je napr. väzba medzi sodíkom a chlórom. Sodík má vo valenčnej (tretej)vrstve jeden osamotený elektrón a výhodnejšie by preňho bolo zbaviť sa elektrónu, pretože na zaplnenie tretej vrstvy by potreboval odniekiaľ získať ď’alších sedem elektrónov. To by ale znamenalo veľký energetický výdaj,preto je ľahšie ak sa takého elektrónu sodík zbaví a ostane mu kompletne zaplnená druhá vrstva. Opačný prípad je chlór, ktorý má na valenčnej (tiež tretej) vrstve sedem elektrónov. Jemu je zase jednoduchšie na vytvorenie zaplnenej valenčnej vrstvy jeden elektrón prijať ako sedem odovzdať. Ak sa k sebe atómy sodíka a chlóru dostanú dostatočne blízko k sebe, je preto pre obidva atómy najvýhodnejšie, ak sodík odovzdá svoj jeden elektrón chlóru. Takýto proces má za následok to, že v sodíku bude počet protónov o jeden vyšší ako elektrónov, teda atóm sodíka bude mať vo výslednici kladnýnáboj (stane sa z neho katión) a atóm chlóru bude mať o súčet protónov naopak o jeden nižší, čiže jeho výsledný náboj bude záporný (stane sa z neho anión). Vytvorená elektrickápolarizácia spomínaných atómov potom umožní ich pritahovanie Coulombovskými silami (obr. 1). Z toho dôvodu sa zvykne tejto väzbe hovoriť aj heteropolárna. Prirodzeným predpokladom k vytvoreniu iónovej väzby medzi atómami je ich nízka iónizačná energia,čiže energia potrebná na odovzdanie elektrónov. Okrem Coulombovskej interakcie sa na iónovej väzbe v nepatrnej miere (asi 1 až2%) podieľajú aj van der Waalsové sily.
Pre iónové kryštály je typická ľahká štiepateľ’nosť, krehkosť, tvrdosť a vysoká teplota tavenia.Pri nízkych a stredných teplotách považujeme iónové kryštály za dobré tepelné a elektrickéizolanty,ale pri vyších teplotách blízko teploty tavenia ich už môžeme považovať za elektricky vodivé. Príčinou je to, že v iónových kryštáloch chýba fermiho plyn a elektrickávodivosť sa realizuj cez samotné ióny, ktorých pohyb nie je tak ľahký ako v prípade elektrónov. Pre svetlo vo viditeľnej oblasti spektra sú iónové kryštály väčšinou priehľ’adné,silne však pohlcujú svetlo z infračervenej oblasti niektorých vlnových dĺžok. Taktiež súdobre rozpustné v polárnych kvapalinách, ako je napr. voda.
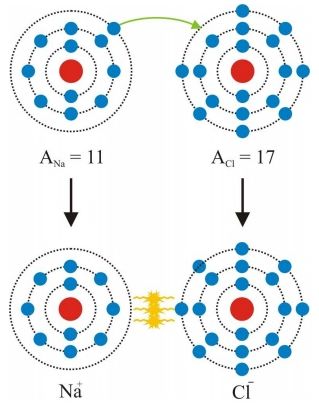
Obr. 1:Model iónovej väzby.Atóm sodíka odovzdá valenčný elektrón atómu chlóru, čím sa z nich stanú katión a anión.
2.2 Kovalentná väzba
Kovalentná väzba (taktiež nazývaná aj valenčná väzba) sa uskutočňuje medzi neutrálnymi atómami a je zabezpečená elektrónovým párom. To znamená, že ak by sme uvažovali dva atómy vodíka, tak do kovalentnej väzby by prispievali obidva svojim jedným elektrónom (obr.2),čím sa vytvorí elektrónový pár. Tieto elektróny sú potom zdieľ’ané oboma atómami vodíka, namiesto toho, aby boli vo výlučnom ,,vlastníctve“ len jedného z nich, ako je tomu v prípade iónových väzieb. Elektróny tvoriace väzbu majú potom tendenciu k čiastočnej lokalizácii medzi dvoma atómami, ktoré spájajú. Samozrejmosťou je, že elektróny tvoriace elektrónový pár majú antiparalelné spiny. Pretože na kovalentnej väzbe sa môžu podielaťiba valenčné elektróny a zároveň každý elektrón len v jednej väzbe, je počet väzieb, ktorými môže byť daný atóm viazaný k ostatným, rovný počtu jeho valenčných elektrónov. Ak bysme si zobrali za príklad atómy uhlíka, ktoré majú po štyri valenčné elektróny, zistili by sme, že ak majú medzi sebou vytvoriť kovalentnú väzbu, tak každý z atómov by bol schopný vytvoriťpo štyri elektrónové páry, ktoré by zdieľal so štyrmi najbližšími atómami. Na rozdiel od iónovej väzby, kde každý ión môže pôsobiť na všetky dostatočne blízke ióny vo svojom okolí,smeruje v kovalentnej väzbe pôsobenie daného atómu iba k tomu atómu, s ktorým zdieľ’a elektrónový pár.
Od kryštálov s iónovou väzbou existuje plynulý prechod ku kryštálom s kovalentnou väzbou.Preto je niekedy ťažké uhádnuť, do akej miery je určitá väzba iónová, alebo kovalentná. Dnes už existuje niekoľko metód ako to stanoviť. Vo všeobecnosti sa však dá povedať,že prvky z prvej alebo druhej skupiny periodickej tabuľky budú s prvkami zo šiestej alebo siedmej skupiny tvoriť v tuhom stave iónové väzby. Ďalšou nápovedou môže byť koordinačné číslo.Iónové kryštály majú vysoké koordinačné číslo a kovalentné (typickým príkladom je diamant s koordinačným číslom 4) naproti tomu nízke.Napokon,je dosť tažké si predstaviť,ako by atóm mohol vstúpiť do čisto kovalentnej väzby so šiestimi, alebo až ôsmimi elektrónmi.
Čisto kovalentných kryštálov je v našom okolí málo. Najznámejšie sú diamant,kremík,germánium alebo karbid kremíka. Všetky kovalentné kryštály sú tvrdé, v porovnaní s ostatnými majú extrémne vysoký bod tavenia, a sú nerozpustné vo všetkých bežných kvapalinách. Pre kovalentné kryštály sú typické kohézne energie 3 až 8 eV/atóm, čo je približne rovnako ako v iónových kryštáloch.
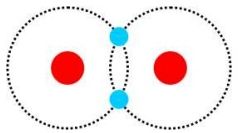
Obr. 2: Kovalentná väzba medzi dvoma atómami vodíka.
2.3 Kovová väzba
V mriežke kovových kryštálov sú v uzlových bodoch mriežky umiestnené kladné ióny kovu,medzi ktorými sa zdanlivo chaoticky pohybujú voľné elektróny oddelené od atómov počas vzniku iónov. Tieto elektróny, tvoriace fermiho plyn, majú v prípade alkalických kovov najväčší príspevok k väzobnej energii. Štatisticky pripadajú zvyčajne jeden až dva takéto elektróny na jeden atóm. V prechodových kovoch a kovoch, prispievajú k väzobnej energii významnou mierou predovšetkým viazané elektróny z vnútorných vrstiev. Napr. v železe alebo wolframe je veľká časť väzobnej energie tvorená elektrónmi z d periódy. Všeobecne sa dá povedať, že kovové väzby tvorené na základe voľných elektrónov sú slabšie než kovovéväzby vytvorené viazanými elektrónmi. V každom prípade je teda kovová väzba výsledkom príťažlivosti medzi voľnými elektrónmi a katiónmi (obr. 3) a viazanými elektrónmi a katiónmi.
Takže kovové prvky, ktoré majú nízke valenčné číslo, odovzdávajú svoje valenčné elektróny do spoločné priestoru fermiho plynu, ktorý slúži prostredníctvom príťažlivosti opačných polarít, ako ,spojivo“kladných iónov. Napr.hliník má tri valenčné elektróny. Tie odovzdá na vytvorenie kvázi voľne sa pohybujúceho fermiho plynu a stane sa z neho trojmocný katión.Takto kladne nabitý ión je potom udržiavaný vzájomnou príťažlivou silou so záporne nabitými elektrónmi fermiho plynu. V zahraničnej literatúre je zvykom označovať túto väzbu pojmom väzba voľných elektrónov.
Jedným z dôsledkov nenasýtenej povahy kovovej väzby je malá pevnosť kryštálov v porovnaní s iónovými alebo kovalentnými kryštálmi. Kryštálom s kovovou väzbou pripisujeme aj dobrú tvárnosť a kujnosť, ktorá je následkom nestacionarity voľných elektrón. Atóm, ktorý by sa ináč z väzby odtrhol, tak veľmi rýchlo nájde v obiehajúcom prúde voľných elektrónov novú väzbu. Najpozoruhodnejším dôsledkom kovových kryštálov je však schopnosť valenčných elektrónov vytvárať fermiho plyn, čo je predpokladom vynikajúcej elektrickej vodivosti. Hodnoty väzobnej energie v kovových kryštáloch sa zvyčajne pohybujú v intervale 0,6 až 3,6 eV/atóm. Príznačný pre kovové kryštály je lesklýpovrch.

Obr.3:Schematické načrtnutie kovovej väzby. Pre jednoduchosť schémy sú červenou farbou naznačené jadrá atómov spolu s vnútornými vrstvami elektrónov. Modrou farbou súnaznačené len voľ’né elektróny.
2.4 Van der Waalsová väzba
Van der Waalsová väzba sa osobitne v kovoch neuplatňuje. Nájdeme ju v kryštáloch jódu,chlóru, kslíka, vodíka a mnohých organických zlúčenín. Oplatí sa ju však spomenúť,pretože v kovoch alebo polokovoch sa môže uplatniť ako sekundárna väzba k silnejšej iónovej alebo kovalentnej väzbe. Typickým príkladom toho je grafit, v ktorom sa na bazálnych rovinách uplatňuje kovalentná väzba a na prizmatických rovinách van der Waalsová. To je vlastne aj príčinou mäkkosti a ľ’ahkej stierateľ’nosti grafitu.
Podstata vzniku van der Waalsovej interakcie (známa aj ako Londonová, alebo tiežmolekulová interakcia) spočíva v interakcii elektrických dipólových momentov najbližších atómov. Tento typ väzby sa rozdeľuje na typ dipól – dipól a typ dipól – indukovaný dipól.Prvý typ sa uplatňuje medzi atómami, ktoré majú permanentné dipólové momenty. Druhýtyp sa spája s atómami, ktoré svojim permanentným dipólovým momentom indukujúdipólový moment u susedných atómov, ktoré tento dipólový moment permanentný nemajú.Totiž aj v tých atómoch, ktorých priemerný elektrický dipólový moment je rovný nule,existuje určitý nenulový premenný moment vyvolaný okamžitou polohou elektrónov v atóme. V takom atóme je síce elektrónová distribúcia symetrická, no nie je konštantná. To znamená,že nastávajú okamihy, keď sa pre daný atóm mení dipólový moment,resp.nadobúda nejaké hodnoty. Zmena okamžitého elektrické poľ’a spojeného s týmto okamihom vyvolá v susedných atómoch indukovaný dipólový moment, pretože zmena distribúcie elektrónov okolo jadra atómu ovplyvňuje distribúciu elektrónov v okolí druhého jadra atómu. Interakcia dipólových momentov s momentom východzích atómov tak vedie ku vzniku prítažlivých síl medzi atómami (obr. 4).
Van der Waalsové sily sú najslabšie zo všetkých štyroch typov a vyznačujú sa krátkym dosahom, čo je dokumentované nízkou teplotou tavenia a varu tých prvkov, u ktorých sa uplatňuje iba táto väzba. Van der Waalsové kryštály sú známe ako veľmi dobré izolátory.Typické hodnoty väobnej energie v týchto kryštáloch sa pohybujú v intervale 0,04 až 0,3eV/atóm.
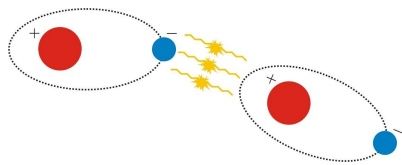
Obr. 4:van der Waalsová väzba.
3. Záver
Vo väčšine materiálov sa vždy uplatňujú kombinácie dvoch alebo dokonca až troch typov väzieb. Existencia jedného typu väzby je ojedinelá. Napr. v železe môžeme vypozorovaťkombináciu kovovej a kovalentnej väzby. Zliatiny dvoch a viacerých kovov sú poväčšine viazané kombináciou kovovej a iónovej väzby, a to obzvlášť v tom prípade, ak je velkýrozdiel v elektronegativite prvkov tvoriacich zliatinu. Pre keramické a polovodičovémateriály je zase príznačná kombinácia kovalentnej a iónovej väzby, pričom platí, že s narastajúcim rozdielom v elektronegativite prvkov, vzrastá podiel iónovej väzby.
Použitá literatúra
[1] ASKELAND D.R.: The science and engineering of materials. 2nd. edition, Chapman and Hall, UK,1990, ISBN 0-412-34260-X.
[2] KITTEL CH.: Úvod do fyziky pevných látek. Academia, Praha, 1985, ISBN 21-103-85.
[3] BEISER A.: Úvod do moderní fyziky. Academia, Praha, 1975, ISBN 104-21-852.
[4] ASCROFT N.W., MERMIN N.D.: Solid State Physics. Cornell University,Harcourt Inc.,Orlando, USA, 1976, ISBN 0-03-083993-9.
[5] GIANCOLI D.C.:Physics for scientist and engineers with modern physics.3rd.edition,Prentice Hall, New Jersey,2000, ISBN 0-13-021517-1.
[6] BLATT F.J.: Modern physics. McGraw-Hill, Inc., USA,1992, ISBN 0-07-005877-6.[7] de BOER F. R. et al.: Cohesion in metals. Transition metal alloys. 2nd. edition, North-Holland Physics Publishing, Amsterdam, 1989, ISBN 0-444-87098-9.